Fe + HNO3 → Fe(NO3)3 + NO+ H2O là phản ứng oxi hóa khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng Fe + HNO3 → Fe(NO3)3 + NO+ H2O
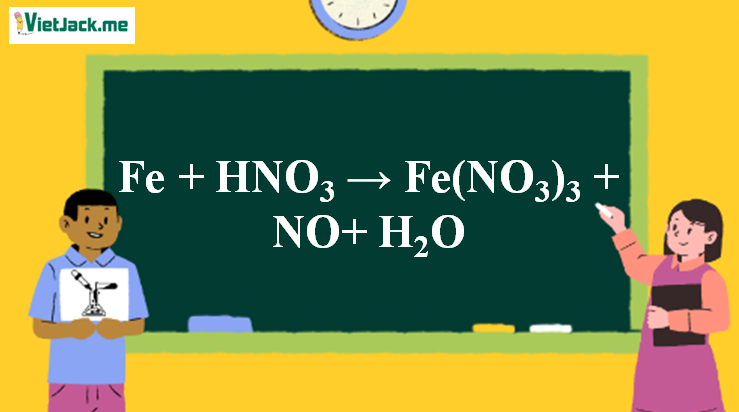
1. Phương trình phản ứng Fe + HNO3 loãng
Fe + 4HNO3 → Fe(NO3)3 + NO↑ + 2H2O
2. Cách cân bằng phương trình Fe + HNO3 → Fe(NO3)3 + NO + H2O
Xác định số oxi hóa của các nguyên tố thay đổi
Fe0 + HN+5O3 → Fe+3(NO3)3+ N+2O + H2O
|
1x 1x |
Fe0 → Fe3+ + 3e N+5 + 3e → N+2 |
Vậy ta có phương trình: Fe + 4HNO3 → Fe(NO3)3 + NO↑ + 2H2O
3. Điều kiện phản ứng Fe tác dụng với HNO3
HNO3 loãng dư
4. Cách tiến hành phản ứng cho Fe tác dụng HNO3
Cho Fe (sắt) tác dụng với dung dịch axit nitric HNO3
5. Hiện tượng hóa học
Kim loại tan dần tạo thành dung dịch muối Muối sắt(III) nitrat và khí không màu hóa nâu trong không khí NO thoát ra.
6. Bản chất của các chất tham gia phản ứng
6.1. Bản chất của Fe (Sắt)
- Trong phản ứng trên Fe là chất khử.
- Fe là kim loại tác dụng được với các axit HNO3, H2SO4 đặc.
6.2. Bản chất của HNO3 (Axit nitric)
- Trong phản ứng trên HNO3 là chất oxi hoá.
- Đây là một monoaxit mạnh, có tính oxi hóa mạnh có thể nitrat hóa nhiều hợp chất vô cơ.
7. Tính chất hóa học cơ bản của sắt
7.1. Tác dụng với phi kim
Với oxi: 3Fe + 2O2 Fe3O4
Với clo: 2Fe + 3Cl2 2FeCl3
Với lưu huỳnh: Fe + S FeS
Ở nhiệt độ cao, sắt phản ứng được với nhiều phi kim.
7.2. Tác dụng với dung dịch axit
Tác dụng với với HCl, H2SO4 loãng
Fe + 2HCl → FeCl2 + H2
Tác dụng với H2SO4 đặc, nóng; HNO3 đặc:
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 4HNO3 → Fe(NO3)3 + NO↑ + 2H2O
Fe + 6HNO3 → Fe(NO3)3 + 3NO2 ↑ + 3H2O
Không tác dụng với H2SO4 đặc nguội, HNO3 đặc, nguội
7.3. Tác dụng với dung dịch muối
Đẩy được kim loại yếu hơn ra khỏi muối
Fe + CuSO4 → FeSO4 + Cu
Fe + AgNO3 → Fe(NO3)2 + Ag
7.4. Ứng dụng của Fe
- Sắt có trong những đồ dùng cá nhân như: dao, kềm, kéo, kệ sắt, các loại dụng cụ gia đình khác,…
- Sắt ở trong các đồ nội thất như: bàn ghế, khung cửa, tủ kệ, cầu thang,…
- Các loại máy móc trong gia đình như máy xay, máy giặt, bồn rửa cũng có sắt.
- Trong giao thông vận tải sắt cũng đóng vai trò rất quan trọng.
- Sắt là bộ khung sườn cho những công trình xây dựng như nhà cửa, cầu, tòa nhà,…
8. Tính chất hóa học của HNO3
- Axit nitric là một dung dịch nitrat hydro có công thức hóa học HNO3 . Đây là một axit khan, là một monoaxit mạnh, có tính oxy hóa mạnh có thể nitrat hóa nhiều hợp chất vô cơ, có hằng số cân bằng axit (pKa) = −2.
- Axit nitric là một monoproton chỉ có một sự phân ly nên trong dung dịch, nó bị điện ly hoàn toàn thành các ion nitrat NO3− và một proton hydrat, hay còn gọi là ion hiđroni.
H3O+ HNO3 + H2O → H3O+ + NO3-
- Axit nitric có tính chất của một axit bình thường nên nó làm quỳ tím chuyển sang màu đỏ.
- Tác dụng với bazo, oxit bazo, muối cacbonat tạo thành các muối nitrat
2HNO3 + CuO → Cu(NO3)2 + H2O
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2
- Axit nitric tác dụng với kim loại: Tác dụng với hầu hết các kim loại trừ Au và Pt tạo thành muối nitrat và nước .
Kim loại + HNO3 đặc → muối nitrat + NO + H2O ( to)
Kim loại + HNO3 loãng → muối nitrat + NO + H2O
Kim loại + HNO3 loãng lạnh → muối nitrat + H2
Mg(rắn) + 2HNO3 loãng lạnh → Mg(NO3)2 + H2 (khí)
- Nhôm, sắt, crom thụ động với axit nitric đặc nguội do lớp oxit kim loại được tạo ra bảo vệ chúng không bị oxy hóa tiếp.
- Tác dụng với phi kim (các nguyên tố á kim, ngoại trừ silic và halogen) tạo thành nito dioxit nếu là axit nitric đặc và oxit nito với axit loãng và nước, oxit của phi kim.
C + 4HNO3 đặc → 4NO2 + 2H2O + CO2
P + 5HNO3 đặc → 5NO2 + H2O + H3PO4
3C + 4HNO3 loãng → 3CO2 + 4NO + 2H2O
- Tác dụng với oxit bazo, bazo, muối mà kim loại trong hợp chất này chưa lên hóa trị cao nhất:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
FeCO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
- Tác dụng với hợp chất:
3H2S + 2HNO3 (>5%) → 3Skết tủa + 2NO + 4H2O
PbS + 8HNO3 đặc → PbSO4 kết tủa + 8NO2 + 4H2O
Ag3PO4 tan trong HNO3, HgS không tác dụng với HNO3.
- Tác dụng với nhiều hợp chất hữu cơ: Axit nitric có khả năng phá hủy nhiều hợp chất hữu cơ, nên sẽ rất nguy hiểm nếu để axit này tiếp xúc với cơ thể người.
9. Bài tập vận dụng liên quan
Câu 1. Cho 11,2 gam Fe tan hoàn toàn trong dung dịch HNO3 loãng dư, sau phản ứng thu được V lít NO (đktc, sản phẩm khử duy nhất). Giá trị của V là:
A. 6,72 lít
B. 2,24 lít
C. 3,36 lít
D. 4,48 lít
Lời giải:
Đáp án: D
Số mol của sắt bằng: nFe = 0,2 mol.Fe + 4HNO3→ Fe(NO3)3 + NO↑+ 2H2O => nNO = 0,2 => VNO = 0,2.22,4 = 4,48 lít
Câu 2. Tính chất vật lý nào dưới đây là của sắt:
A. Sắt có màu vàng nâu, nhẹ, có ánh kim, dẫn điện và dẫn nhiệt kém.
B. Sắt có màu trắng bạc, nặng, có ánh kim, dẫn điện, dẫn nhiệt tốt
C. Sắt có màu trắng xám, nặng, có ánh kim, dẫn điện và dẫn nhiệt tốt
D. Sắt có màu trắng xám, nhẹ, có ánh kim, dẫn điện và dẫn nhiệt tốt.
Lời giải:
Đáp án: C
Tính chất vật lý nào dưới đây là của sắt:
C. Sắt có màu trắng xám, nặng, có ánh kim, dẫn điện và dẫn nhiệt tốt
Câu 3. Cho phương trình hóa học sau: Al + HNO3 → Al(NO3)3 + NO + H2O
Tổng hệ số tối giản của phương trình sau:
A. 8
B. 9
C. 12
D. 16
Lời giải:
Đáp án: B
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
Câu 4. Biết A là oxit, B là muối, C và D là kim loại. Cho các phản ứng sau:
a) A + HCl → 2 muối + H2O
b) B + NaOH → 2 muối + H2O
c) C + muối → 1 muối
d) D + muối → 2 muối
Các chất A, B, C, D có thể là
A. Fe3O4, CaCO3, Fe, Cu.
B. Fe3O4, CaCO3, Cu, Fe.
C. Fe2O3, Ca(HCO3)2, Fe, Cu.
D. Fe3O4, Ca(HCO3)2, Fe, Cu.
Lời giải:
Đáp án: D
a) Fe3O4 (A) + 8HCl → FeCl2 + 2FeCl3 + 4H2O
b) Ca(HCO3)2 (B) + NaOH → CaCO3 + Na2CO3+ 2H2O
c) Fe (C) + 2FeCl3 → 3FeCl2
d) Cu (D) + 2FeCl3 → CuCl2+ 2FeCl2
Câu 5. Nhận định nào sau đây là sai?
A. HNO3 phản ứng với tất cả bazơ.
B. HNO3 (loãng, đặc, nóng) phản ứng với hầu hết kim loại trừ Au, Pt.
C. Tất cả các muối amoni khi nhiệt phân đều tạo khí amoniac.
D. Hỗn hợp muối nitrat và hợp chất hữu cơ nóng chảy có thể bốc cháy.
Lời giải:
Câu 6. Nhiệt phân hoàn toàn Fe(NO3)2 trong không khí thu được sản phẩm gồm
A. FeO, NO2, O2.
B. Fe2O3, NO2.
C. Fe, NO2, O2.
D. Fe2O3, NO2, O2.
Lời giải:
Đáp án: D
4Fe(NO3)2 → 2Fe2O3 + 8NO2 + O2
Câu 7. Để điều chế Fe(NO3)2 ta có thể dùng phản ứng nào sau đây?
A. Fe + dung dịch AgNO3 dư
B. Fe + dung dịch Cu(NO3)2
C. FeO + dung dịch HNO3
D. FeS + dung dịch HNO3
Lời giải:
Đáp án: B
A. Fe + dung dịch AgNO3 dư => loại vì
Fe + 2AgNO3 → Fe(NO3)2+ 2Ag
Fe(NO3)2 + AgNO3 dư → Fe(NO3)3 + Ag
B. Fe + dung dịch Cu(NO3)2
Fe + Cu(NO3)2 → Cu + Fe(NO3)2
C. FeO + dung dịch HNO3
3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
D. FeS + dung dịch HNO3
FeS + 12HNO3 → 9NO2 + Fe(NO3)3 + 5H2O + H2SO4
Câu 8. Chỉ sử dụng dung dịch HNO3 loãng, có thể nhận biết được bao nhiêu chất rắn riêng biệt sau: MgCO3, Fe3O4, CuO, Al2O3?
A. 1
B. 2
C. 3
D. 4
Lời giải:
Đáp án: D
Dùng HNO3 có thể nhận biết được cả 4 chất.
Chất rắn tan dần, có khí không màu thoát ra → MgCO3
MgCO3 + 2HNO3 → Mg(NO3)2 + CO2 ↑ + H2O
+ Chất rắn tan dần, thoát ra khí không màu hóa nâu trong không khí, dung dịch thu được màu vàng nâu → Fe3O4
3Fe3O4 + 28HNO3 → 9Fe(NO3)3 (vàng nâu) + NO + 14H2O
2NO (không màu) + O2 → 2NO2 (nâu đỏ)
Chất rắn tan dần, sau phản ứng thu được dung dịch màu xanh
CuO + 2HNO3 → Cu(NO3)2 (xanh) + H2O
Chất rắn tan dần, sau phản ứng thu được dung dịch không màu
Al2O3 + 6HNO3 → 2Al(NO3)3(không màu) + 3H2O
Câu 9. Trong các phản ứng sau, phản ứng nào HNO3 không đóng vai trò chất oxi hóa?
A. ZnS + HNO3(đặc nóng)
B. Fe2O3 + HNO3(đặc nóng)
C. FeSO4 + HNO3(loãng)
D. Cu + HNO3(đặc nóng)
Lời giải:
Đáp án: B
A. ZnS + HNO3 (đặc nóng)
ZnS + 8HNO3 → 6NO2 + Zn(NO3)2 + 4H2O + SO2
B. Fe2O3 + HNO3 (đặc nóng)
Fe2O3+ 6HNO3 → 2Fe(NO3)3 + 3H2O
C. FeSO4 + HNO3(loãng)
FeSO4 + 4HNO3 → Fe(NO3)3 + H2SO4+ NO2 + H2O
D. Cu + HNO3 (đặc nóng)
Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2H2O
Câu 10. Cho 16,8 gam bột Fe vào 400 ml dung dịch HNO3 1M, thu được khí NO duy nhất, lượng muối thu được cho vào dung dịch NaOH dư thu được kết tủa. Nung nóng kết tủa mà không có không khí thu được m gam chất rắn. Tính m?
A. 10,8 gam
B. 21,6 gam
C. 7,2 gam
D. 16,2 gam
Lời giải:
Đáp án: A
nFe = 0,3 mol , nHNO3 = 0,4 mol
Phương trình hóa học
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
Ban đầu: 0,3 0,4
Phản ứng 0,1 0,4 0,1 0,1
Kết thúc 0,2 0 0,1 0,1
→ 2Fe(NO3)3 + Fe dư → 3Fe(NO3)2
Bđ 0,1 0,2
Pư 0,1 0,05 0,15
Kt 0 0,15 0,15
Fe(NO3)2 → Fe(OH)2 → FeO
0,15 0,15
→ Khối lượng FeO thu được: 0,15.72 = 10,8 gam
Câu 11. Cho các mệnh đề sau:
1) Các muối nitrat đều tan trong nước và đều là chất điện li mạnh.
2) Ion NO3- có tính oxi hóa trong môi trường axit.
3) Khi nhiệt phân muối nitrat rắn ta đều thu được khí NO2.
4) Hầu hết muối nitrat đều bền nhiệt. Các mệnh đề đúng là :
A. (1), (2), (3).
B. (2) và (4).
C. (2) và (3).
D. (1) và (2).
Lời giải:
Đáp án: D
Các mệnh đề đúng là: (1) và (2)
(3) sai vì muối nitrat của K, Na, Ba, Ca nhiệt phân không thu được khí NO2
(4) sai vì các muối nitrat hầu hết kém bền nhiệt
Câu 12. Cho m gam bột Fe vào 800 ml dung dịch hỗn hợp gồm Cu(NO3)2 0,2M và H2SO4 0,25M. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,6m gam hỗn hợp bột kim loại và V lít khí NO (sản phẩm khử duy nhất của N+5, ở đktc). Giá trị của m và V lần lượt là:
A. 10,8 và 4,48.
B. 10,8 và 2,24.
C. 17,8 và 4,48.
D. 17,8 và 2,24.
Lời giải:
Đáp án: D
nCu(NO3)2 = 0,8.0,2 = 0,16 mol
nH2SO4 = 0,8.0,25 = 0,2 mol
Do sau phản ứng còn dư hỗn hợp bột kim loại ⇒ Fe còn dư, Cu2+ hết, muối Fe2+
3Fe + 2NO3- + 8H+ → 3Fe2+ + 2NO + 4H2O (1)
0,32 0,4
0,15 0,1 0,4 0,1
Fe + Cu2+ → Fe2+ + Cu
V = 0,1.22,4 = 2,24 lít
m – (0,15 + 0,16).56 + 0,16.64 = 0,6m
m = 17,8 gam
Câu 13. Dãy các chất và dung dịch nào sau đây khi lấy dư có thể oxi hoá Fe thành Fe (III)?
A. HCl, HNO3 đặc, nóng, H2SO4 đặc, nóng
B. Cl2, HNO3 nóng, H2SO4 đặc, nguội
C. bột lưu huỳnh, H2SO4 đặc, nóng, HCl
D. Cl2, AgNO3, HNO3 loãng
Lời giải:
Đáp án: D
Cl2, AgNO3, HNO3 loãng
2Fe + 3Cl2 → 2FeCl3
Các phản ứng hóa học xảy ra là:
Fe + 2AgNO3→ Fe(NO3)2 + 2Ag (1)
Fe(NO3)2 + AgNO3→ Fe(NO3)3+ Ag (2)
Fe + 4HNO3→ Fe(NO3)3 + NO↑ + 2H2O
Câu 14: Dung dịch FeSO4 không làm mất màu dung dịch nào sau đây?
A. Dung dịch KMnO4 trong môi trường H2SO4
B. Dung dịch K2Cr2O7 trong môi trường H2SO4
C. Dung dịch Br2
D. Dung dịch CuCl2
Lời giải:
Đáp án: D
Dung dịch CuCl2
Câu 15. Cho m gam bột Fe vào 800 ml dung dịch hỗn hợp gồm Cu(NO3)2 0,2M và H2SO4 0,25M. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,6m gam hỗn hợp bột kim loại và V lít khí NO (sản phẩm khử duy nhất của N+5, ở đktc). Giá trị của m và V lần lượt là:
A. 10,8 và 4,48.
B. 10,8 và 2,24.
C. 17,8 và 4,48.
D. 17,8 và 2,24.
Lời giải:
Đáp án: D
Do sau phản ứng thu được hỗn hợp bột KL nên Fe dư, phản ứng tạo muối Fe2+
nCu2+ = nCu(NO3)2 = 0,16mol;
nNO3- = 2nCu(NO3)2 = 0,32 mol;
nH+ = 2nH2SO4 = 0,4 mol
Phương trình hóa học
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O (Ta thấy: < nên H+ hết, NO3- dư)
0,15 ← 0,4 → 0,1 → 0,1
Fe + Cu2+ → Fe2+ + Cu
0,16 ← 0,16 → 0,16
Vậy nFe pư = 0,15 + 0,16 = 0,31 mol
=> mKL sau = mFe dư + mCu => m - 0,31.56 + 0,16.64 = 0,6m => m = 17,8 gam
=> VNO = 0,1.22,4 = 2,24 lít
Câu 16. Dãy các chất và dung dịch nào sau đây khi lấy dư có thể oxi hoá Fe thành Fe(III) ?
A. HCl, HNO3 đặc, nóng, H2SO4 đặc, nóng
B. Cl2, HNO3 nóng, H2SO4 đặc, nguội
C. bột lưu huỳnh, H2SO4 đặc, nóng, HCl
D. Cl2, AgNO3, HNO3 loãng
Lời giải:
Câu 17. Có 4 kim loại để riêng biệt: Ag, Al, Mg, Fe. Chỉ dùng hai thuốc thử có thể phân biệt được từng chất
A. Dung dịch NaOH; phenolphtalein
B. Dung dịch NaOH, dung dịch HCl
C. Dung dịch HCl, giấy quỳ xanh
D. Dung dịch HCl, dung dịch AgNO3
Lời giải:
Đáp án: B
Dùng dung dịch HCl thì nhận ra được :
Kim loại Ag vì không có phản ứng
+ 3 kim loại còn lại đều tạo khí
Phương trình hóa học
Mg + 2HCl → MgCl2 + H2↑
2Al + 6HCl → 2AlCl3 + 3H2↑
Fe + 2HCl → FeCl2 + H2↑
Dùng vài giọt dung dịch NaOH thì nhận ra được
+ Dung dịch MgCl2( có chứa kim loại ban đầu là Mg ) với hiện tượng có kết tủa trắng xuất hiện
Phương trình hóa học:
MgCl2 + 2NaOH → Mg(OH)2↓+ 2NaCl
+ Dung dịch AlCl3 ( có chứa kim loại ban đầu là Al ) với hiện tượng có kết tủa keo trắng sau đó tan dần
Phương trình hóa học:
AlCl3 + 4NaOH → NaAlO2 + 3NaCl + 2H2O (PTHH viết gộp )
+ Dung dịch FeCl3 ( có chứa kim loại ban đầu là Fe) với hiện tượng có kết tủa màu trắng xanh xuất hiện , sau đó chuyển sang màu nâu khi để lâu ngoài không khí
Phương trình hóa học: FeCl2 + 2NaOH → Fe(OH)2↓+ 2NaCl
Câu 18. Hòa tan Fe3O4 vào dung dịch H2SO4 loãng dư thu được dung dịch X. Tìm phát biểu sai
A. Dung dịch X làm mất màu thuốc tím
B. Cho NaOH dư vào dung dịch X thu được kết tủa để lâu ngoài không khí kết tủa có khối lượng tăng lên.
C. Dung dịch X tác dụng được với Zn
D. Dung dịch X không thể hòa tan Cu
Lời giải:
Đáp án: D
Fe3O4 + 4H2SO4→ FeSO4 + Fe2(SO4)3 + 4H2O
A đúng: FeSO4 làm mất màu thuốc tím trong H2SO4 loãng
B. FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4
C. FeSO4 + Zn → ZnSO4 + Fe
D sai: Cu + Fe2(SO4)3 → 2FeSO4 + CuSO4
Câu 19. Cho sắt tác dụng với dung dịch H2SO4 loãng thu được V lít khí H2 (đktc), dung dịch thu được cho bay hơi được tinh thể FeSO4.7H2O có khối lượng là 27,8 gam. Thể tích khí H2 (đktc) được giải phóng là
A. 4,48 lít.
B. 8,19 lít.
C. 2,24 lít.
D. 6,23 lít.
Lời giải:
Đáp án: C
Bảo toàn nguyên tố Fe: nFe = nFeSO4.7H2O = = 0,1 mol
=> nH2 = 0,1 mol => V = 0,1.22,4 =2,24 lít
Câu 20. Cho 22,72 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng (dư), thu được 2,688 lít khí NO (sản phẩm khử duy nhất, ở đktc) và dung dịch X. Cô cạn dung dịch X thu được m gam muối khan. Tính m?
A. 49,09.
B. 38,72.
C. 77,44.
D. 34,36.
Lời giải:
Đáp án: C
nNO= = 0,12 mol
Coi hỗn hợp gồm Fe (x mol), O (y mol)
=> 56x + 16y = 22,72 (1)
Fe0 → Fe+3 + 3e
x → x → 3x
O0 + 2e → O-2
y → 2y
N+5 + 3e → N+2
0,36→ 0,12
Bảo toàn e => 3x = 2y + 0,36 (2)
(1),(2) => x = 0,32; y = 0,3
=> nFe(NO3)3 = nFe= 0,32mol
=> m = 0,32.242 = 77,44 gam
Câu 21. Nung nóng 25,2 gam Fe ngoài không khí sau một thời gian thu được m gam hỗn hợp X gồm Fe, FeO, Fe2O3 và Fe3O4. Hỗn hợp này phản ứng hết với dung dịch H2SO4 đặc nóng (dư), thu được 8,4 lít khí SO2 (sản phẩm khử duy nhất, ở đktc). Tính m?
A. 15 gam
B. 30 gam
C. 25 gam
D. 20 gam
Lời giải: